Si la décision préliminaire est finalisée ce printemps, elle limiterait la couverture aux patients dans les essais cliniques randomisés.
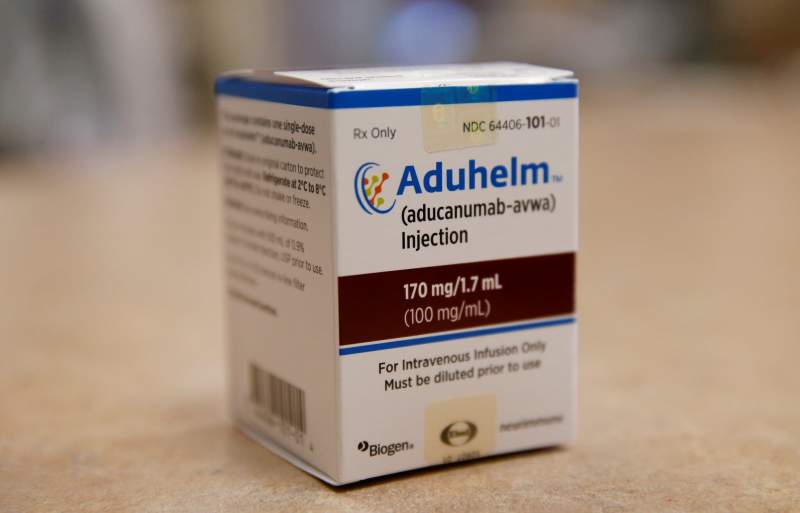
Aduhelm a été approuvé par la FDA en juin dans une décision qui a été critiquée par de nombreux médecins et experts de la maladie d’Alzheimer, qui ont déclaré que le traitement présentait des risques de sécurité importants et des avantages incertains pour les patients lors de ses essais cliniques.
Crédit…
Photo de la piscine par Jessica Rinaldi
Par Pam Belluck
Les responsables de Medicare ont déclaré mardi que le programme fédéral d’assurance maladie devrait restreindre sa couverture du nouveau médicament controversé contre la maladie d’Alzheimer Aduhelm aux patients qui participent à des essais cliniques approuvés, une mesure qui limiterait considérablement le nombre de patients qui pourraient utiliser le médicament coûteux.
Dans une décision préliminaire , les Centers for Medicare et Medicaid Services ont déclaré qu’après un examen approfondi des preuves scientifiques et des opinions de nombreuses parties prenantes différentes, ils avaient conclu qu’il subsistait des doutes importants quant à savoir si les avantages potentiels d’Aduhelm pour les patients l’emportent sur la sécurité. des risques.
En conséquence, l’agence a déclaré qu’elle ne couvrirait que les patients qui reçoivent le médicament dans le cadre d’essais contrôlés randomisés – considérés comme l’étalon-or de l’évaluation scientifique car ils comparent les patients recevant un médicament avec un groupe témoin de patients, généralement ceux recevant un placebo. .
Le Dr Lee Fleisher, médecin-chef de l’agence et directeur de son Center for Clinical Standards, a déclaré mardi que les preuves montraient que «bien qu’il puisse y avoir un potentiel de promesse avec ce traitement, il existe également un potentiel de préjudice grave pour les patients. Ces dommages peuvent inclure des maux de tête, des étourdissements, des chutes et des saignements cérébraux.
Le Dr Fleisher a ajouté : « Notre objectif principal est de protéger les bénéficiaires contre les dommages potentiels d’une intervention sans avantages connus dans la population de Medicare. En tant que médecin praticien, je ne saurais trop insister sur la nécessité de comprendre les risques et les avantages d’un traitement donné afin de mieux informer les patients et leurs familles dans la prise de décisions concernant leurs soins.
Dans un communiqué, Biogen, la société qui fabrique Aduhelm, a déclaré que la position de l’agence “nie le fardeau quotidien des personnes vivant avec la maladie d’Alzheimer” et que l’exigence d’essai clinique “exclura presque tous les patients qui pourraient en bénéficier”.
La décision est très inhabituelle , “la première fois que CMS a limité l’accès des bénéficiaires de Medicare à un médicament approuvé par la FDA de cette manière”, a déclaré James Chambers, chercheur au Center for the Evaluation of Value and Risk in Health au Tufts Medical Center. . Le programme paie presque toujours pour les médicaments que la Food and Drug Administration a approuvés, du moins pour les conditions médicales désignées sur leur étiquette, ont déclaré lui et d’autres experts en politique de la santé.
Comprendre le nouveau médicament contre la maladie d’Alzheimer Aduhelm
- Approbation de la FDA : L’agence a approuvé le premier nouveau traitement contre la maladie d’Alzheimer en 18 ans malgré un débat acharné sur son efficacité.
- Risques potentiels pour la sécurité : les inquiétudes concernant Aduhelm se sont intensifiées après qu’une femme de 75 ans dans un essai clinique a développé un gonflement du cerveau et est décédée .
- Limites de l’assurance-maladie : les responsables ont déclaré que le programme fédéral ne devrait couvrir le médicament que pour les patients qui participent à des essais cliniques approuvés .
- Comprendre la maladie d’Alzheimer : obtenez des réponses aux questions courantes sur la maladie, qui touche environ 30 millions de personnes dans le monde.
Environ 1,5 million d’Américains souffrent du type de maladie pour laquelle la FDA a approuvé le traitement : un léger déclin cognitif lié à la maladie d’Alzheimer. Mais si la décision devient définitive ce printemps, elle pourrait limiter l’utilisation de l’Aduhelm à “peut-être quelques milliers de patients qui s’inscrivent dans des essais randomisés au cours des trois à cinq prochaines années”, a déclaré le Dr Sean Tunis, un ancien responsable de Medicare. , qui est maintenant senior fellow au centre Tufts.
La restriction, a déclaré le Dr Tunis, “signifie effectivement que la grande majorité des patients qui répondent aux critères d’approbation de la FDA” n’obtiendront pas le médicament. “C’est donc presque la même chose qu’une décision de non-couverture”,
finale de l’agence, attendue d’ici le 11 avril après une période de commentaires du public qui s’étend d’ici à la mi-février, s’appliquerait également à des médicaments similaires pour la maladie d’Alzheimer qui sont actuellement en cours d’essai et devraient être examinés pour approbation par la FDA.
Aduhelm a été approuvé par la FDA en juin, une décision vigoureusement critiquée par de nombreux médecins et experts de la maladie d’Alzheimer, car les résultats des essais cliniques ont montré qu’il présentait des risques de sécurité importants et des avantages incertains pour les patients.
Le Congrès enquête pour savoir si la FDA a travaillé trop étroitement avec Biogen et pourquoi Aduhelm a été approuvé malgré les fortes objections de certains hauts responsables de la FDA et du comité consultatif indépendant de l’agence.
Jusqu’à présent, seul un petit nombre de patients – une fraction du nombre que Biogen et les analystes de l’industrie avaient initialement prévu – ont utilisé Aduhelm, un anticorps monoclonal administré en perfusion mensuelle qui est également connu sous son nom scientifique, aducanumab.
De nombreux grands systèmes de santé américains, dont la Cleveland Clinic et Mount Sinai, ont refusé d’offrir le médicament , citant des questions sur ses avantages et ses risques. Le mois dernier, un groupe d’experts et de défenseurs de la santé d’Alzheimer a appelé la FDA à retirer Aduhelm du marché et a déclaré qu’ils soutenaient un effort visant à déposer une pétition formelle auprès de l’agence pour le retirer.
La FDA elle-même a reconnu dans son approbation d’Aduhelm qu’il n’y avait pas suffisamment de preuves qu’il aiderait les patients. Au lieu de cela, il a donné son feu vert au médicament – le premier nouveau traitement contre la maladie d’Alzheimer en 18 ans – dans le cadre d’un programme appelé « approbation accélérée », qui permet l’autorisation de médicaments non prouvés pour des maladies graves avec peu d’options de traitement si le médicament affecte un mécanisme biologique d’une manière considérée « raisonnablement susceptible de prédire un bénéfice clinique ».
Il a basé la qualification du médicament pour une approbation accélérée sur la réduction par Aduhelm d’une protéine, appelée amyloïde, qui s’agglutine en plaques dans le cerveau des personnes atteintes de la maladie d’Alzheimer. Mais de nombreux spécialistes de la maladie d’Alzheimer affirment que des recherches approfondies ont montré peu de preuves que la réduction de l’amyloïde ralentit le déclin cognitif.
La FDA a également demandé à Biogen de mener un autre essai clinique pour déterminer si le médicament fournissait des preuves de bénéfice. Dans les années qu’il faudra pour que cet essai soit terminé, Aduhelm sera à la disposition des patients.
La décision de couverture de Medicare est considérée comme cruciale pour l’avenir d’Aduhelm, dont le prix est de 28 200 $ par an et par patient. Environ 80 pour cent des patients éligibles au médicament sont assez âgés pour bénéficier d’une couverture par Medicare.
Biogen a initialement fixé le prix du médicament à 56 000 $ par an, mais a réduit le prix de moitié lemois dernier après des mois de ventes faibles. Avant la baisse des prix de Biogen, la division actuarielle de Medicare, agissant sans savoir quelle serait la décision de couverture, imposait l’ une des augmentations les plus importantes jamais enregistrées des primes Medicare Part Bpour 2022, en partie en raison de la possibilité d’une couverture Aduhelm.
Après la baisse des prix de Biogen, des groupes de défense des patients atteints d’Alzheimer ont exhorté CMS à réduire l’augmentation des primes. Lundi, le secrétaire à la Santé et aux Services sociaux, Xavier Becerra, a déclaré qu’il chargeait CMS de réexaminer la hausse des primes“compte tenu de la variation dramatique du prix du médicament contre la maladie d’Alzheimer, Aduhelm”.
Les responsables de l’assurance-maladie sont censés déterminer la couverture en fonction de la question de savoir si un médicament est « raisonnable et nécessaire », et lors d’un briefing avec des journalistes, les responsables ont déclaré que le prix n’était pas un facteur dans leur décision.
Le Dr Fleisher, reconnaissant la nature inhabituelle de la décision, a déclaré que « CMS utilise son autorité fournie par le Congrès pour déterminer si le médicament est considéré comme raisonnable et nécessaire, ce qui signifie que les avantages de l’amélioration de la cognition l’emportent sur les dommages dans la population de Medicare. “
Plusieurs groupes de défense des patients, dont l’Alzheimer’s Association, avaient fait pression pour l’approbation du médicament et pour la couverture de Medicare, et ils ont exprimé leur forte déception face à la décision préliminaire de l’agence.
Harry Johns, directeur général de l’Alzheimer’s Association, a déclaré dans un communiqué que la décision équivalait à “une discrimination choquante contre toutes les personnes atteintes de la maladie d’Alzheimer”, ajoutant qu'”avec cette approche, l’accès au traitement ne serait désormais accessible qu’à quelques privilégiés, ceux qui ont accès aux institutions de recherche, exacerbant et créant de nouvelles inégalités en matière de santé.
Medicare’s proposed criteria for coverage also says the randomized trials must be approved by C.M.S. or the National Institutes of Health. Officials listed a series of criteria that clinical trials would need to follow in order to be considered approved, including that the trials be conducted in a “hospital-based outpatient setting” and that patients have evidence of amyloid in their brains. It said the agency would cover the cost of the main method for diagnosing the presence of amyloid, a PET scan, and that approved trials would also include any that are supported by the National Institutes of Health.
Tamara Syrek Jensen, directrice de la couverture et de l’analyse du Center for Clinical Standards and Quality de CMS, a déclaré que l’agence considérait comme une exigence que les essais cliniques incluent une population de patients diversifiée, contrairement aux patients pour la plupart blancs qui ont participé aux essais précédents d’Aduhelm. . Les personnes noires ou latino-américaines sont plus à risque de contracter la maladie d’Alzheimer.
“Compte tenu du manque décevant d’inclusion des populations mal desservies dans les essais antérieurs, nous avons besoin d’une population représentative”, a déclaré Mme Jensen, ajoutant “Nous pensons que c’est important pour cette maladie”.
L’essai que Biogen est tenu de mener par la FDA peut également demander l’approbation du CMS, a-t-elle déclaré, et s’il répond aux critères de l’agence, Medicare couvrira les coûts des participants à cet essai.
Pam Belluck est une écrivaine sur la santé et la science dont les honneurs incluent le partage d’un prix Pulitzer et le prix Nellie Bly de la meilleure histoire en première page. Elle est l’auteur de Island Practice, un livre sur un médecin inhabituel. @Pam Belluck